Ropresa Eye Drops 0.02% (Netarsudyl Mesylate) 안약, Santen Pharmaceutical Co., Ltd. 한국은 2023년 2월 3일 국내 물품으로 인정되었습니다. 며칠 전 심의 결과가 나왔고, 공개된 정보를 바탕으로 어떤 약인지, 제출 및 면제 일자는 언제인지, 심의 과정에서 특이 사항은 없었는지 등을 검토할 예정이다.
의약품에 대한 기본 정보
개방각녹내장 또는 고안압증 환자의 안압을 낮추기 위한 점안액으로, 새로운 화학구조를 주성분으로 하는 신약입니다.
- 상품명 : 로프레사 점안액 0.02%(netarsudyl mesylate)
- 바라보다 : 무색투명한 액체가 들어있는 불투명한 백색의 플라스틱 용기에 든 점안제
- 회사 이름 : 한국산텐제약(주)
- 약물 분류 : 처방약
- 승인일자 : 2023-02-03
- 권한 확인 유형 : 신약 성서
- 원료와 양 : 이 약 1밀리리터 중 네타르수딜 메실레이트 0.2849밀리그램(네타르수딜로서 0.2밀리그램)
첨가물 : 만니톨, 염화벤잘코늄액, 붕산, 수산화나트륨, 주사용수 - 유효성 효과 : 다음 질환의 안압 강하 – 개방각녹내장, 고안압증
- 복용량 : 성인 – 1일 1회 저녁에 1방울을 환부에 점안한다. 주입하는 것을 잊은 경우 다음날 밤에 주입하십시오. 1일 2회 투여(또는 1방울 이상)는 권장되지 않습니다.
- 보관 방법 : 밀폐용기, 냉장보관(2~8℃).
- 유용한 수명 : 제조일로부터 36개월
- 검토 대상 : 6 년
- RMP 대상 : 오
- 포장 정보 : 재사용 가능) 2.5ml/병 (1병/케이스)
확인 정보 허용
- 외국인 허가 상태 : 미국(’12/17/18), 유럽(’11/19/19), 영국(’01/21/01), 독일(’11/19/19), 이탈리아(’11/19/19)
- 입학처 : 라이선스 총책임자
- 검토 부서 : 종양항생제과(Anyu), 첨단의약품품질심사과(Kishi), 의약품안전성평가(위해성)과
- GMP 심사부서 : 의약품품질부
- 일정 확인 : 아래 일정으로 신청부터 승인까지 거의 1년이 걸렸습니다.
2022-03-28 : 품목허가 신청
2022/04/20: 활성 물질(DMF) 등록을 위한 데이터에 대한 기본 보충 자료
2022년 6월 21일: 제품 승인 데이터에 1차 추가
2022년 10월 21일: DMF 데이터에 대한 1차 추가 답변 제출
2022년 12월 9일 : 기사 공개 데이터 1차 추가 답변 전송
2022년 12월 28일: DMF 데이터에 2차 추가
2023/01/09: DMF 데이터 2차 보완답안 제출
2023.01.11 : GMP 데이터 처리 완료
2023년 1월 19일 : 품목허가자료 2차 추가
2023.01.30 : 직위승인자료 2차 보완응답 제출
2023/02/03: 품목 승인 절차 완료
제출자료 검토
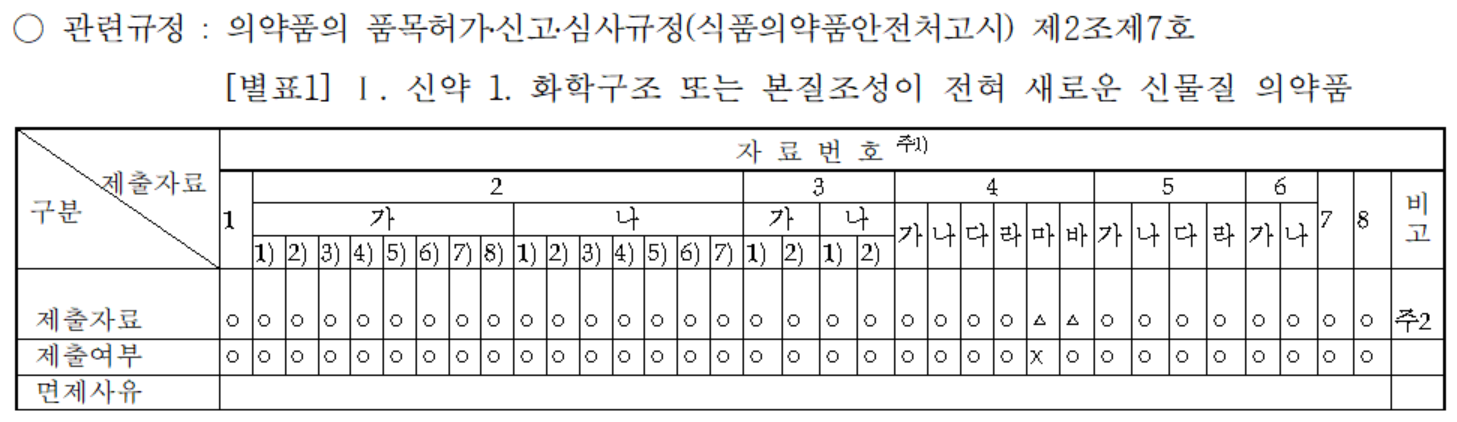
신약인 만큼 위의 표를 통해 대부분의 자료가 제출되었음을 알 수 있다. 제출된 각 데이터에 대해 제출된 데이터는 다음과 같이 요약되며 미구현 항목은 함께 표시됩니다.
1. 기원 또는 발견 및 발전경력에 관한 정보
ROCK 억제제인 Netarsudil(AR-13324)은 원 개발사인 Aerie Pharmaceuticals에서 발굴 및 개발하였으며, Rhopressa/Rhocklatan의 한국을 포함한 아시아 국가에서의 제품 등록에 대한 책임과 권한은 Santen Pharmaceutical Co., Ltd.에 위임되었습니다. 위임. AR-13324는 비임상 연구 및 1상 및 2상 임상 연구에서 안압(IOP)을 감소시키는 것으로 나타났으며, 3상에서 티몰롤 말레에이트 0.5% A와 함께 안약 및 안압을 사용한 2개의 중추적인 3상 임상 연구에서 나타났습니다. 임상 강하 시험(총 3건)을 진행하여 강하 효과에 대한 비열등성을 입증하여 품목허가를 신청하였습니다.
2. 구조결정 및 물리화학적 성질에 관한 자료(품질자료)
- 원료의약품(Netarsudyl Mesylate) 품질 시험 품목
: 성상, 동정시험, 순도시험(유연물질, 잔류용제시험, 기타시험), 건조감량/강열감량/수분, 기타시험(미생물한도), 정량법 - 완제의약품 품질시험항목
: 성상, 확인시험, pH, 순도시험(유연물질), 정량, 질량(용량)편차/조제균질시험, 무균시험, 불용성입자시험, 불용성물질시험, 기타시험
3. 안정성 데이터
완제품은 LDPE 병, LLDPE 노즐(팁), PP 뚜껑/상자에 보관하고 5°C에서 장기보관 시험과 25°C/40%RH에서 가속시험을 실시하였다. ~8℃) 보관, 제조일로부터 36개월을 인정받았습니다.
4. 독성 데이터
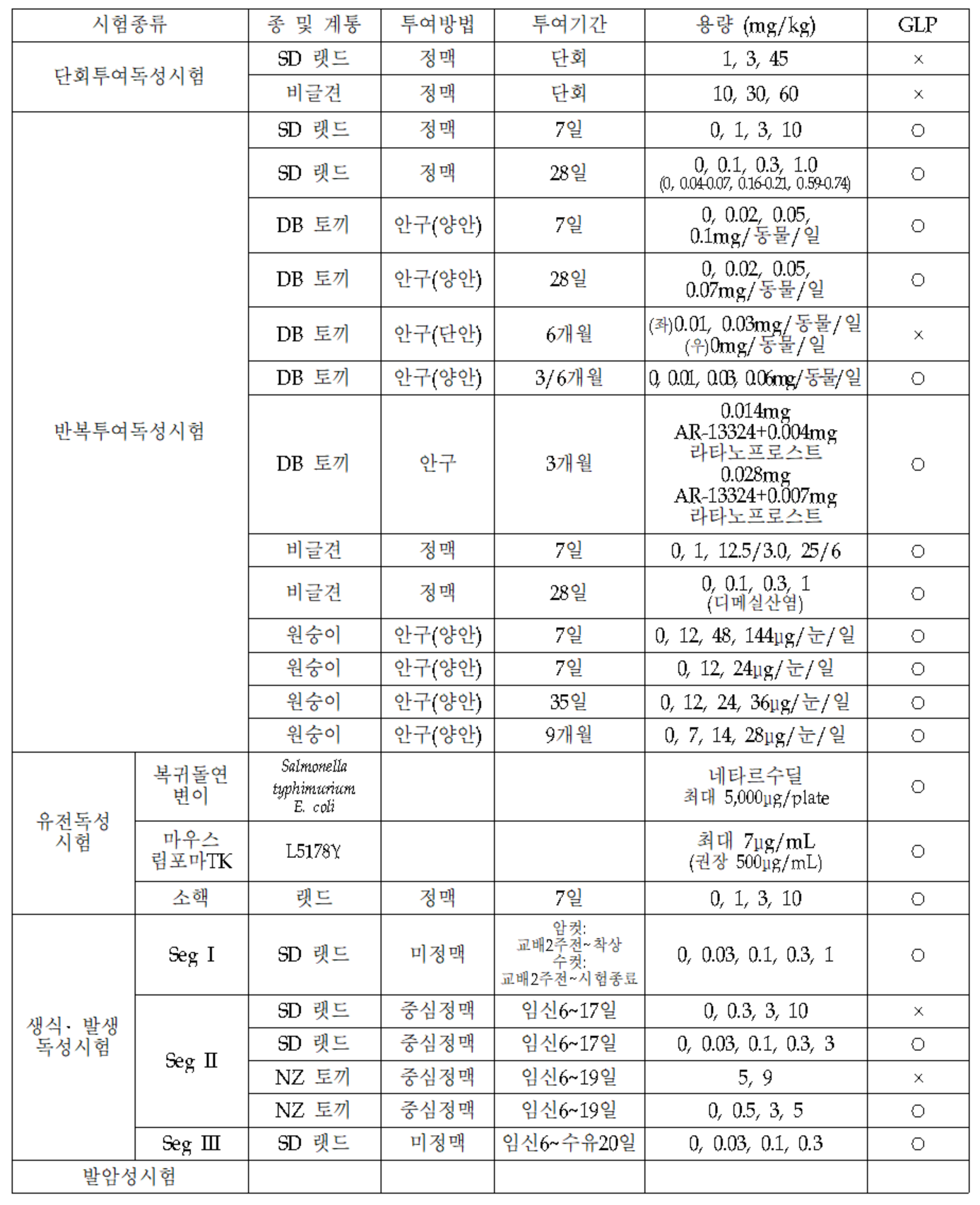
구현되지 않은 기사
- 발암성 시험토끼와 원숭이에서 수행된 여러 국소 안구 안전성 연구의 독성동태학(TK) 결과에 근거하여, 예상 임상 용량에서 네타르수딜과 그 거울상이성질체 및 각각의 대사물의 혈장 노출은 아래의 측정 가능한 범위 내에 있었고 이 가설이 확인되었습니다. 건강한 피험자를 대상으로 한 1상 임상시험에서 정량하한치(LLOQ, 0.100 ng/mL)를 초과하는 네타르수딜의 혈장농도는 임상시험에서 관찰되지 않았다. 또한 토끼와 원숭이를 대상으로 한 반복 점적 독성 시험에서 전종양 병변의 징후는 관찰되지 않았으며, DB토끼를 이용한 분포 시험 및 물질 균형 시험 색소 침착 토끼에서 국소 조직 반응 또는 기타 병태생리학적 반응의 징후가 관찰됨 일어나지 않았다고 합니다.
따라서 ICH S1A 가이드라인에 따른 발암성 시험 면제를 요청하였다. - 국소 내성 시험의 경우 전신(정맥)투여에 대한 반복투여독성시험에 안전성시험이 포함되어 있어 수행하지 않았다.
- 기타 독성 시험의 경우, 투여 1일부터 7일째까지 매일 투여 전, 마지막 투여 후, 14일째에 안자극성을 평가하였으므로 토끼 점안제에 대한 반복투여독성시험을 실시하지 않았다. 회복기간 후.
- 광독성 시험의 경우, 네타르수딜은 멜라닌에 결합하여 멜라닌 함유 조직(안구 포도막, 색소성 피부, 수막)에 분포하며 방사능 측정 기간 동안 크게 감소하지 않았다. 병변이 관찰되지 않았기 때문에 제출되지 않았습니다.
5. 약리작용에 관한 정보
Rho 키나아제에 대한 네타르수딜 및 관련 화합물의 억제 효과를 시험관 내에서 평가하였고, 억제 활성을 배양 세포를 사용한 액틴 스트레스 섬유 및 초점 접합부 힘 파괴 검정에서 평가하였다. 또한, 네타르수딜의 IOP 저하 효과는 토끼와 원숭이에서 연구되었습니다.
안전성약리시험은 다음과 같이 실시하였으며 호흡기계 평가는 제출하지 않았다.
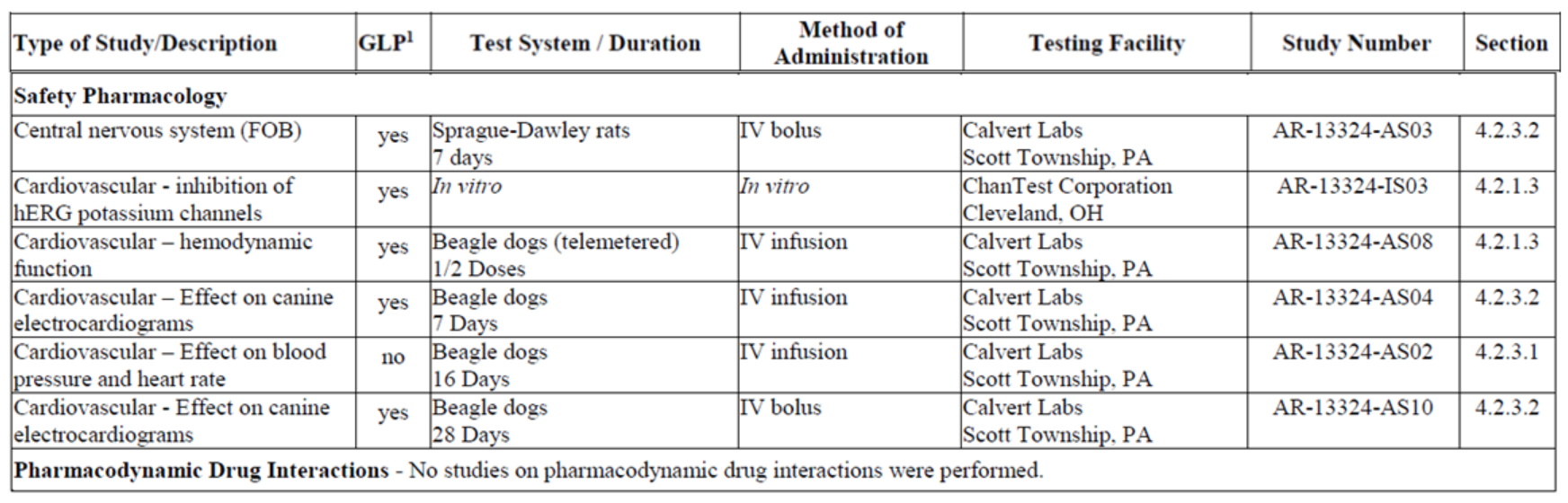
ADME의 경우 netarsudil은 전신흡수 후 빠른 분포와 소실과 일치하게 정맥투여 시 감소하였고, 혈장노출은 용량의존적인 반면, netarsudil은 용량에 비례하였다.
6. 임상시험 결과자료

총 8건의 임상 연구 데이터가 제출되었으며, GCP 준수 인증서로 데이터의 신뢰성을 확보하고 미국 승인 시점에 제출했습니다. 이들 안약은 외용제로 사용하기 때문에 인종간 차이를 보이는 요인이 거의 없고 전신적 효과를 나타낼 가능성도 낮아 가교자료는 제외하였다.
7. 해외 이용현황 자료
미국과 유럽의 승인이 접수되었습니다.
- 미국 : RHOPRESSA® (Netarsudil 점안액) 0.02%, 국소 안구용., Aerie Pharmaceuticals, Inc., 2017년 12월 18일 승인
- 유럽 EMA : Rhokiinsa 200 micrograms/ml 안약, 용액, Aerie Pharmaceuticals Ireland, Limited(제조), Santen Oy(핀란드, 유통), 승인일자 2019/11/19
8. 국내 유사제품과의 비교검토 및 해당 의약품의 성상자료 등
Korea Kowa Co., Ltd.와 비교 데이터 국내 유사 제품인 그라나텍 점안액 0.4%(리파스딜염산염수화물)가 출품됐다.
9. 위험 관리 계획
RMP는 다음과 같이 계획되었습니다.
- 중요한 잠재적 위험 : 방부제(염화벤잘코늄)를 함유한 점안액 사용으로 인한 안자극, 안구건조증, 눈물막 파괴, 각막 및 결막 상피 손상에 대한 보고를 자발적으로 수집함.
- 중요한 결핍 정보 : 자발적인 보고를 통한 임부 및 수유부 사용물품 수집, 네타수딜의 장기 안전성에 대한 시판 후 조사, 각막상피손상 환자 사용물품
위의 의약품 정보는 NEDRUG(의약품 안전국) 의약품 정보 >>>>> 의약품 정보 검색 탭에서 확인할 수 있습니다.
